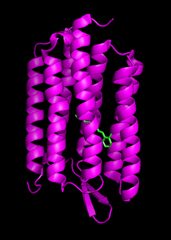
Halobacterium salinarum(H. Salinarum)やNatronobacterium pharaonis(N. pharaonis)な どの古細菌は単細胞生物であり、非常に塩濃度の濃い湖(塩湖)などに生息しています。これらの古細菌は普通の細菌等と違い、光のエネルギーを使い色々な生 理的な活動を行っていることが知られており、昔から興味を持って研究されています。 H. Salinarumなどは細胞の外側にある細胞膜によって包まれていますが、この細胞膜の 中に非常に多量のbacteriorhodopsin(bR)という紫色をしたタンパク質が含まれています。
普通多くのタンパク質は可視光を吸収しないため、人間の目には無色透明に見えます。それにもかかわらずbRが紫色をしてい るのは、その内部にall-trans retinalと呼ばれる色素を持っているためであることが分かっています(図1で緑色で示された部分がall-trans retinal)。先ほどH. Salinarumは光のエネルギーを使って生活していると言うことを 述べましたが、それにはこのall-trans retinalが深く関わっています。 all-trans retinalはbRの216番目のアミノ酸残基であるリシン残基に共有結合しています。bRに光が入射し、このall-trans retinalが励起されるとtrans-cis異性化が起こり、色素部分の構造が変化します。これをきっかけとして、 構造が変化したretinalに押し出される形でbRのタンパク質部分も構造が変化し、アミノ酸や内部水の配向変化や水素結合の変化が起こります。 retinalのリシン残基と結合する根元のところには Schiff塩基と呼ばれる炭素と共有結合した窒素原子があり、励起前の状態ではこれにプロトンが結合してretinalの根元部分は正の電荷を帯びてい ます。本来このSchiff塩基の塩基としての強さはそれほど強くないのですが、bRの場合その周辺に脱プロトン化し負の電荷を帯びたアスパラギン酸残基 (対イオン)が存在するためプロトン化した状態が安定化されます。しかし、タンパク質が光を吸収し、構造が変化するとこのSchiff塩基の周辺の環境が 変化し、pKaが下がるためプロトンがretinalの根元部分に結合できなくなり、タンパク質内の別の残基(もしくは水分子)へと受け渡され最終的に細 胞の外側(図1の下側)へ放出されます。しかしその後膜をはさんだ反対側(図1の上側)から新しいプロトンがタンパク質内部に入り、再びShiff塩基に 結合します。 これによりbRが光励起されると細胞膜をはさんで一つのプロトンが移動し、膜の内と外でプロトン濃度(正確には化学ポテンシャル)に差が出来ます。このよ うな状態になると濃度勾配を利用して再び細胞膜が空いている部分を通してプロトンが再び細胞内に入ってこようとします。古細菌の場合このプロトンの移動の エネルギーを用いてATPaseというタンパク質がATPといわれる分子の合成を行い、更にそのATPの化学エネルギーを用いて色々な生理活動を行いま す。したがって H. Salinarumなどの古細菌は光のエ ネルギーを用いて、自らの活動に必要な化学エネルギーを得ており、そのエネルギー変換の役目を光受容タンパク質であるbRが果たしていることになります。 古細菌はbR以外にも細胞膜中にbRによく似たタンパク質を持っています。現在のところbRのほかに3種類の古細菌型のタンパク質が知られており、それぞ れhalorhodopsin(hR)、sensary rhodopsin I (SRI)、sensory rhodopsin II (SRII、phoborhodopsin)と名づけられています。 このうちhRはbRと同じ光駆動のイオンポンプを行うタンパク質として知られています。しかしbRと異なり塩化物イオン(Cl-イオン)をポンプし、その 方向もbRガ細胞の内側から外側であるのに対し、hRは細胞の外から内へとイオンを運びます。 また残り二つの古細菌型ロドプシンであるSRIとSRIIはbRやhRと異なりイオンポンプの役目は持っておらず、その代わりに古細菌がまわりの光に向 かって移動したり、また逃げる行動をとる走光性とよばれる生理活動に関係しています。例えばSRIを例にとると、SRIは細胞膜中でトランスデューサータ ンパク質(HtrI)と言うタンパク質と複合体を形成していると考えられています。SRIは長波長の赤い光を主に吸収するすることが知られていますが、励 起されたSRIはHtrIに信号を送ってをそれを活性化し、更に活性化したHtrIが細胞質中にあるCheタンパク質群に信号を伝達することによって、最 終的に細胞の外側にある鞭毛の回転運動のパターンを変化させ、細胞が赤い光に向かって泳ぐ行動を起こします。 SRIIはSRIと異なり、逆に青い光を吸収して同じようにSRIIに特異的に結合する別の種類のトランスデューサー(HtrII)に信号を送って細胞が 青い光から逃げるような行動(負の走光性)を起こさせると考えられています。 従って古細菌は細胞中に非常に構造が似通った4つのタンパク質を持ちながら、それぞれに全く異なる機能を持たせ生きていくうえでの生理活動に役立てている ことが分かります。近年タンパク質の構造と機能の相関に付いては非常に興味を持たれて様々な研究が行われていますが、このような古細菌型のロドプシンはそ の良いモデル系として注目されています。 次へ→
|
戻る