◇ミオグロビンCO体(MbCO)の光解離過程における構造ダイナミクス
myoglobin とは...
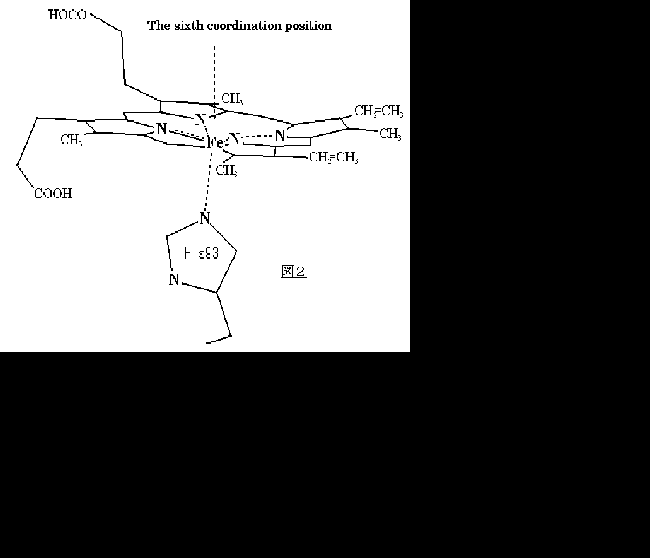
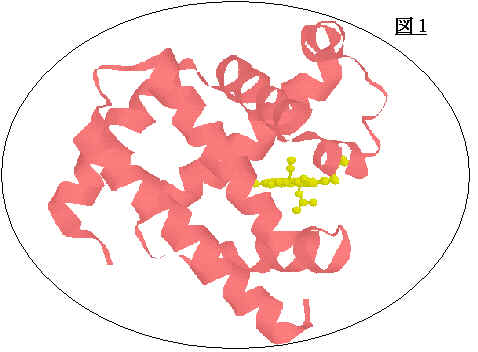 ミオグロビンは筋肉中で酸素を貯える小さな球状タンパクで157個のアミノ酸のポリペプチド鎖一本と鉄ポルフィリンから成っている。ミオグロビンはタンパク質の複雑な働きの原型として早くから研究がされており、その立体構造は他のタンパクに先駆けて、1958年にKendrewらのX線回折法により決定された (図1)。結晶構造によると、8つのαヘリックスから成り、ヘムはEヘリックスとFヘリックスの間にあり、FヘリックスのHis93(近位His)とヘム鉄の配位結合を通してタンパクと結ばれている。ヘム鉄は二つの酸化状態を持ち、様々な小分子(リガンド)と結合するが、図2に示すようにHis93と4つのピロール窒素と配位結合しており、軸上の6番目の位置にリガンドが結合する。酸化状態 (Fe3+,
metMb)ではH2Oやアニオンと結合し、還元状態 (Fe3+,
deoxyMb) ではO2,CO,NO,アリルニトロソ化合物,アルキルCNなどと結合する。生理的に重要であるのは還元状態で、体内では還元状態で酸素を貯蔵している。
ミオグロビンは筋肉中で酸素を貯える小さな球状タンパクで157個のアミノ酸のポリペプチド鎖一本と鉄ポルフィリンから成っている。ミオグロビンはタンパク質の複雑な働きの原型として早くから研究がされており、その立体構造は他のタンパクに先駆けて、1958年にKendrewらのX線回折法により決定された (図1)。結晶構造によると、8つのαヘリックスから成り、ヘムはEヘリックスとFヘリックスの間にあり、FヘリックスのHis93(近位His)とヘム鉄の配位結合を通してタンパクと結ばれている。ヘム鉄は二つの酸化状態を持ち、様々な小分子(リガンド)と結合するが、図2に示すようにHis93と4つのピロール窒素と配位結合しており、軸上の6番目の位置にリガンドが結合する。酸化状態 (Fe3+,
metMb)ではH2Oやアニオンと結合し、還元状態 (Fe3+,
deoxyMb) ではO2,CO,NO,アリルニトロソ化合物,アルキルCNなどと結合する。生理的に重要であるのは還元状態で、体内では還元状態で酸素を貯蔵している。
リガンドの光解離過程
ミオグロビンに結合したリガンドはヘムを光励起することにより、反結合性軌道に遷移し、ピコ秒以内で解離が起こる。タンパクのダイナミクスが、ミオグロビンを用いて数多く成されている理由がここにある。光によって反応をトリガーできると、高速レーザーを用いて非常に短い時間でのダイナミクスの研究が可能になるからである。こうした理由から、フェムト秒からミリ秒までの広範囲の時間領域で、ミオグロビンのリガンド結合解離過程は、様々なレーザー分光法を用いて、数多くの研究がなされている。
上に述べたように、deoxyMb には様々なリガンドが結合するが、どのリガンドも単純な小分子であるので、光解離過程にそれほど差はないのではないかと思われるが、意外にも大きな違いが見られる。NOは光励起後、ピコ秒の時間スケールでほとんどヘムと再結合してしまい、O2もナノ秒以内に50%ほど再結合する。一方、COの場合、数ナノ秒までCOとヘムの再結合が起こらず、ほとんどが数百ナノ秒の時間スケールでタンパクの外へ放出される。そのため、他のリガンドに比べて解析が単純なCO体(MbCO)が光解離後のタンパクの動きなどを研究するためによく用いられている。
リガンド放出の道筋
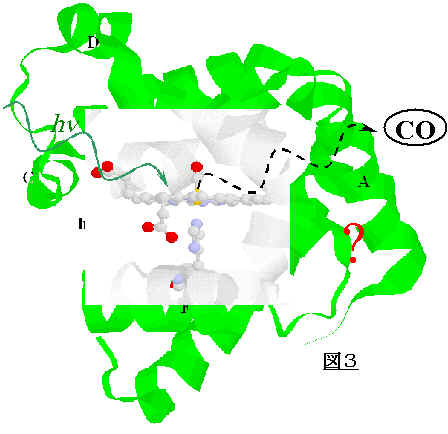 リガンドとヘムが光解離した後、リガンドの一部はタンパクの外へ放出される(CO体では室温で約95%。)ので、リガンドの結合部位とタンパクの外の間にリガンドが通る道筋があると考えられていた。しかし、ミオグロビンの構造を見ると、リガンド結合部位はタンパクに固く覆われていて、リガンドが外へ出る(あるいは外のリガンドがタンパクの中に入る)道筋が全く見当たらない。このことは光励起に伴うタンパク質のコヒーレントな動き、あるいは揺らぎが過渡的な道筋を作っていることを示している。これはミオグロビンの光解離過程で最も興味の持たれる問題のひとつである。
リガンドとヘムが光解離した後、リガンドの一部はタンパクの外へ放出される(CO体では室温で約95%。)ので、リガンドの結合部位とタンパクの外の間にリガンドが通る道筋があると考えられていた。しかし、ミオグロビンの構造を見ると、リガンド結合部位はタンパクに固く覆われていて、リガンドが外へ出る(あるいは外のリガンドがタンパクの中に入る)道筋が全く見当たらない。このことは光励起に伴うタンパク質のコヒーレントな動き、あるいは揺らぎが過渡的な道筋を作っていることを示している。これはミオグロビンの光解離過程で最も興味の持たれる問題のひとつである。
MbCOの光解離過程は可視光吸収法により次のような反応式によって記述される。
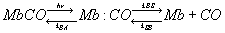
MbCOはCOがヘムに結合した状態、Mb:COはCOがヘムから解離しているが、タンパクの中にいる状態、Mb+COはCOが溶媒の外へ放出された後の状態である。このように吸収法で測定した場合、3状態モデルで記述されるが、ヘムの吸収変化しか見ていないため、CO解離に伴うタンパクの動きなどを見落としている可能性がある。そのために、COの放出される速度や中間体の数について、異なる解釈がなされており、未だにはっきりしていない問題が残っている。そういった問題を解決するには、分子の一部でなく全体を観測できる手法での研究が望まれる。
過渡回折格子法(Transient Grating)による研究
ようやく本題であるが、上で述べた理由により、分子全体を観測できる過渡回折格子法(TG法)を用いれば、MbCO光解離反応でのCOの放出過程やそれに伴うタンパク部分の動きなどが明らかにできると期待される。本研究では、最初に野生種MbCOの実験を行い、構造変化に由来する信号を検出し、体積変化とエネルギー変化を決定したが、それだけでは構造変化の由来がはっきりしなかったため、次のような実験を行った。
(1)狭い間隔の過渡回折格子で測定できるような装置を開発し、回折格子の幅に依存する拡散過程の信号成分を詳しく解析した。
(2)結合部位の近くにあるアミノ酸残基に注目して、遺伝子工学の手法で3種類の変異体を作成し、構造ダイナミクスの比較からその由来を推測した。
実験内容、結果などは後日公開予定。
 ミオグロビンは筋肉中で酸素を貯える小さな球状タンパクで157個のアミノ酸のポリペプチド鎖一本と鉄ポルフィリンから成っている。ミオグロビンはタンパク質の複雑な働きの原型として早くから研究がされており、その立体構造は他のタンパクに先駆けて、1958年にKendrewらのX線回折法により決定された (図1)。結晶構造によると、8つのαヘリックスから成り、ヘムはEヘリックスとFヘリックスの間にあり、FヘリックスのHis93(近位His)とヘム鉄の配位結合を通してタンパクと結ばれている。ヘム鉄は二つの酸化状態を持ち、様々な小分子(リガンド)と結合するが、図2に示すようにHis93と4つのピロール窒素と配位結合しており、軸上の6番目の位置にリガンドが結合する。酸化状態 (Fe3+,
metMb)ではH2Oやアニオンと結合し、還元状態 (Fe3+,
deoxyMb) ではO2,CO,NO,アリルニトロソ化合物,アルキルCNなどと結合する。生理的に重要であるのは還元状態で、体内では還元状態で酸素を貯蔵している。
ミオグロビンは筋肉中で酸素を貯える小さな球状タンパクで157個のアミノ酸のポリペプチド鎖一本と鉄ポルフィリンから成っている。ミオグロビンはタンパク質の複雑な働きの原型として早くから研究がされており、その立体構造は他のタンパクに先駆けて、1958年にKendrewらのX線回折法により決定された (図1)。結晶構造によると、8つのαヘリックスから成り、ヘムはEヘリックスとFヘリックスの間にあり、FヘリックスのHis93(近位His)とヘム鉄の配位結合を通してタンパクと結ばれている。ヘム鉄は二つの酸化状態を持ち、様々な小分子(リガンド)と結合するが、図2に示すようにHis93と4つのピロール窒素と配位結合しており、軸上の6番目の位置にリガンドが結合する。酸化状態 (Fe3+,
metMb)ではH2Oやアニオンと結合し、還元状態 (Fe3+,
deoxyMb) ではO2,CO,NO,アリルニトロソ化合物,アルキルCNなどと結合する。生理的に重要であるのは還元状態で、体内では還元状態で酸素を貯蔵している。
 リガンドとヘムが光解離した後、リガンドの一部はタンパクの外へ放出される(CO体では室温で約95%。)ので、リガンドの結合部位とタンパクの外の間にリガンドが通る道筋があると考えられていた。しかし、ミオグロビンの構造を見ると、リガンド結合部位はタンパクに固く覆われていて、リガンドが外へ出る(あるいは外のリガンドがタンパクの中に入る)道筋が全く見当たらない。このことは光励起に伴うタンパク質のコヒーレントな動き、あるいは揺らぎが過渡的な道筋を作っていることを示している。これはミオグロビンの光解離過程で最も興味の持たれる問題のひとつである。
リガンドとヘムが光解離した後、リガンドの一部はタンパクの外へ放出される(CO体では室温で約95%。)ので、リガンドの結合部位とタンパクの外の間にリガンドが通る道筋があると考えられていた。しかし、ミオグロビンの構造を見ると、リガンド結合部位はタンパクに固く覆われていて、リガンドが外へ出る(あるいは外のリガンドがタンパクの中に入る)道筋が全く見当たらない。このことは光励起に伴うタンパク質のコヒーレントな動き、あるいは揺らぎが過渡的な道筋を作っていることを示している。これはミオグロビンの光解離過程で最も興味の持たれる問題のひとつである。