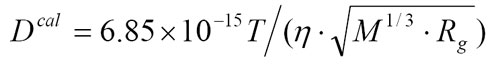TG僠乕儉尋媶撪梕堦棗傊
岝暔棟壔妛尋媶幒傊
抈敀幙奼嶶學悢傪應掕偡傞怴婯庤朄偺奐敪偲偦偺墳梡
偼偠傔偵
丂丂丂懡偔偺惗懱撪斀墳偼丄抈敀幙偑惗懱撪傪堏摦偟峔憿曄壔偡傞偙偲偱婲偙傞丅抈敀幙偺峔憿曄壔傪挷傋傞庤朄偵偼丄CD丄媧廂丄寀岝丄彫妏X慄應掕側偳懡偔偺暘岝妛揑庤朄偑偁傝丄偙傟傑偱悢懡偔偺尋媶偑峴傢傟偰偄傞丅堦曽丄抈敀幙偺摦偒傗偡偝偼奼嶶掕悢偲偄偆暔棟検偱昞偝傟傞丅奼嶶學悢偼丄抈敀幙偺峔憿乮戝偒偝丄宍乯曄壔傗丄抈敀幙偲廃埻偺梟攠偺憡屳嶌梡偵塭嬁偝傟傞偨傔丄抈敀幙偑偐偐傢傞惗懱斀墳偺廳梫側婎慴忣曬偲側傞丅
丂丂丂抈敀幙偺奼嶶掕悢偼丄栺10-10m2s-1偺僆乕僟乕偱偁傞丅偡側傢偪丄1昩娫偵10兪m偟偐摦偐側偄丅偟偨偑偭偰丄挿帪娫娤應偡傞偐丄偁傞偄偼旝彫側曄埵傪娤應偡傞偙偲偵側傞丅偙傟傑偱椙偔梡偄傜傟偰偄傞庤朄偵偼丄Dynamic light scattering(DLS)傗Pulsed-field-gradient NMR(PFG-NMR)側偳偑偁傞偑丄挿帪娫愊嶼偡傞昁梫偑偁傝偁傑傝娙曋偱偼側偐偭偨丅偦偙偱丄変乆偼抈敀幙奼嶶學悢傪娙曋偵抁帪娫偱應掕偱偒傞庤朄傪奐敪偡傞偙偲偵偟偨丅婎慴偲側傞庤朄偼Transient Grating朄乮TG朄乯偱偁傞丅TG朄偼岝斀墳惈暘巕偺暲恑奼嶶傪丄旕忢偵抁帪娫偱娤應偱偒傞丅側偤側傜丄TG朄偵偍偄偰暘巕偑奼嶶偡傞椞堟偼丄儗乕僓乕偵傛傝夁搉揑偵宍惉偝傟偨悢兪m偲偄偆grating娫偩偐傜偱偁傞丅偟偐傕丄TG朄偼3師偺旕慄宍暘岝朄偱偁傞偨傔丄娤應偝傟傞怣崋偼巜岦惈偺椙偄嶶棎價乕儉偱偁傝(専弌岠棪偑崅偄)丄偦偺嫮搙偼奺儗乕僓乕岝嫮搙偺愊偱戝偒偔側傞丅偡側傢偪丄旕忢偵S/N偺傛偄怣崋傪抁帪娫偱摼傞偙偲偑偱偒傞丅
TG朄偺愢柧
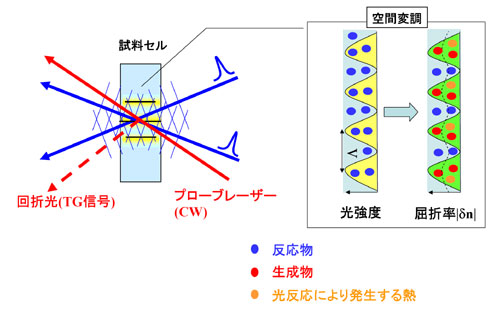
丂丂丂TG朄偱偼丄傑偢丄2杮偺pump岝傪僒儞僾儖僙儖忋偱岎嵎偝偣姳徛偝偣傞丅偦偺寢壥丄僒儞僾儖撪偱岝偺嫮偄晹暘偑廃婜揑偵宍惉偝傟丄岝嫮搙偺姳徛幦傪宍惉偡傞丅偦偆偡傞偲丄岝偺摉偨偭偰偄傞椞堟偱偼暘巕偑岝斀墳偟丄斀墳暔偐傜惗惉暔偵曄姺偝傟傞丅岝偺偁偨偭偰偄側偄椞堟偱偼斀墳暔偺傑傑偱偁傞丅偡側傢偪丄崱搙偼惗惉暔偲斀墳暔偺姳徛幦偑偱偒傞丅偙傟偼丄捠忢偼丄惗惉暔偲斀墳暔偱孅愜棪偑堎側傞偺偱丄孅愜棪偺嵎偺嬻娫暘晍偲側傞丅
偙偙偵probe岝(CW)偑擖幩偝傟偰偄傞偲丄偙偺孅愜棪偺嬻娫暘晍偑夞愜奿巕偲偟偰偼偨傜偒丄probe岝偑Bragg忦審傪枮偨偡妏搙偵夞愜偝傟傞丅偙偺夞愜岝傪岝揹巕憹攞娗偱専弌偡傞丅
帪娫偑偨偮偲丄奼嶶偵傛傝丄斀墳暔偲惗惉暔偲偼崿偠傝偁偄丄夞愜奿巕偼徚柵偟偰偄偔丅偙偺夁掱偵敽偆夞愜岝嫮搙偺帪娫曄壔傪僆僔儘僗僐乕僾偱専弌偡傞丅尭悐帪掕悢偐傜奼嶶學悢偑傕偲傑傞丅
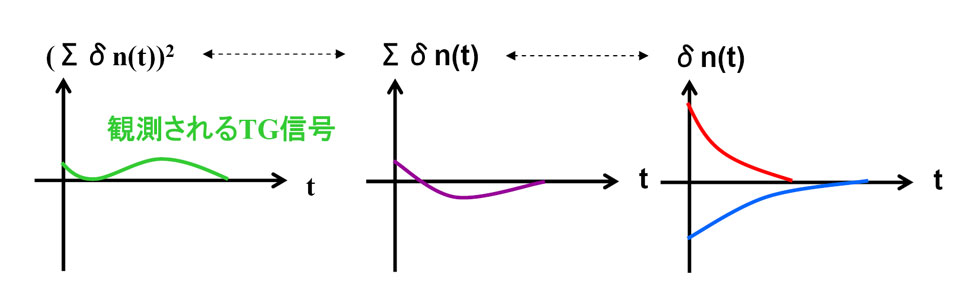
TG怣崋嫮搙偼丄孅愜棪曄壔乮兟n;丂惗惉暔側傜惓丄斀墳暔側傜晧乯偺俀忔偱昞偝傟傞偨傔丄怣崋偑儀乕僗儔僀儞偱愜傝曉偝傟丄嶳宍偺怣崋偑偱偒傞丅
怴婯奼嶶學悢應掕朄乮TG亅HSAB朄乯
丂丂丂TG朄偱奼嶶傪娤應偱偒傞偨傔偺忦審偲偟偰偼丄暘巕偑岝斀墳偟側偗傟偽側傜側偄丅偟偐偟抈敀幙偺懡偔偑岝斀墳惈偱側偄丅偦偺偨傔丄変乆偼抈敀幙傪岝斀墳惈偺掅暘巕偱儔儀儖偟偨丅偦偺嵺丄sample preparation傪娙扨偵偡傞偨傔丄抈敀幙偲帺敪揑偵斀墳偡傞succinimidyl婎傪傕偮暘巕傪慖傫偩乮sulfo-HSAB乯丅
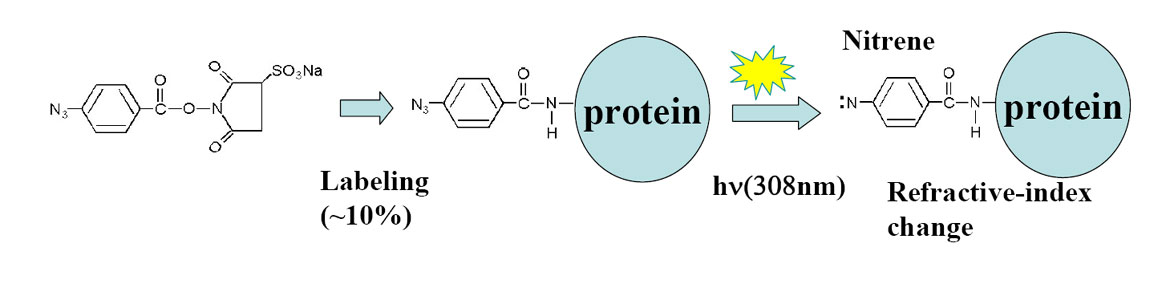
丂丂丂應掕偺寢壥丄戝偒側抈敀幙傎偳丄TG怣崋偺尭悐偑抶偔側偭偨丅偙偺寢壥偼丄戝偒側抈敀幙傎偳奼嶶偑抶偄偲偄偆懨摉側寢壥偱偁傞丅摼傜傟偨奼嶶學悢偼丄偙傟傑偱偺曬崘抣偲傛偔堦抳偟偨丅
TG-HSAB朄偺墳梡丂丂乣儈僆僌儘價儞偺巁曄惈丗奼嶶學悢偲僞儞僷僋幙峔憿偺憡娭乣
丂丂丂師偵忋婰庤朄傪梡偄偰丄儈僆僌儘價儞偺奼嶶學悢傪應掕偟偨丅
丂丂丂儈僆僌儘價儞偼丄嬝擏拞偱巁慺傪挋憼偡傞栶栚傪扴偭偰偄傞丅峔憿偼丄A乣H傑偱俉杮偺傊儕僢僋僗偲偦傟偵旕嫟桳寢崌偟偰偄傞揝億儖僼傿儕儞(僿儉)偐傜惉傞丅儈僆僌儘價儞偼巁惈忦審(pH2)偱丄擇忬懺揑偵巁曄惈偡傞丅偙偺偲偒僿儉偼梟攠偵業弌偟丄桳婡梟攠傪壛偊偰潣漚偡傞偙偲偱丄僿儉傪庢傝彍偔偙偲偑偱偒傞丅pH傪拞惈偵栠偡偲儈僆僌儘價儞偼僿儉偑側偔偰傕丄僿儉偑偁偭偨偲偒偲旕忢偵帡偨峔憿傪偲傞偙偲偑NMR偵傛傝帵偝傟偰偄傞丅僿儉偑柍偄儈僆僌儘價儞傪傾億儈僆僌儘價儞偲偄偆乮僿儉偑偁傞応崌傪摿偵儂儘儈僆僌儘價儞偲屇傇偲偒傕偁傞乯丅傾億儈僆僌儘價儞偼傊儕僢僋僗偺傒偐傜惉傞旕忢偵僔儞僾儖側峔憿傪偟偰偄傞偨傔丄pH-jump傪梡偄偨抈敀幙儕僼僅乕儖僨傿儞僌尋媶偵傛偔梡偄傜傟偰偄傞丅偦偺寢壥丄傾億儈僆僌儘價儞偼2偮偺拞娫忬懺乮I1,I2乯傪宱偰丄folded忬懺傊愜傝偨偨傑傞偙偲偑帵偝傟偨丅
丂丂丂嫽枴怺偄偙偲偵丄傾億儈僆僌儘價儞偼巁曄惈偵偍偄偰丄pH4偱拞娫懱傪傕偮偙偲偑CD應掕偐傜帵偝傟偨丅偦偺屻丄偙偺pH4暯峵拞娫懱偼丄pH-jump幚尡偱娤應偝傟偨I2拞娫懱偲帡偨峔憿傪傕偮偙偲偑帵偝傟偨丅偡側傢偪丄幚尡偑梕堈側暯峵拞娫懱傪梡偄傞偙偲偱丄娙扨偵kinetic拞娫懱偺摿挜偯偗偑偱偒傞丅
丂丂丂崱夞丄変乆偼偙偺拞娫懱偺奼嶶學悢傪應掕偟丄梟攠偲偺憡屳嶌梡傪庡偵挷傋傞偙偲偵偟偨丅
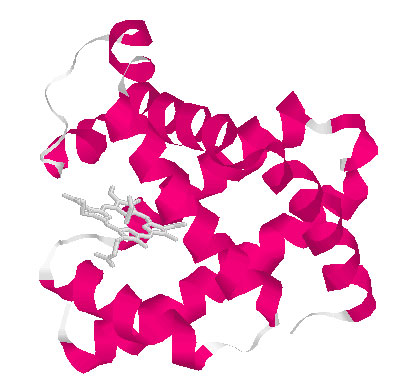
摼傜傟偨奼嶶學悢偺pH曄壔傪222nm偺CD抣偲斾妑偟偨丅
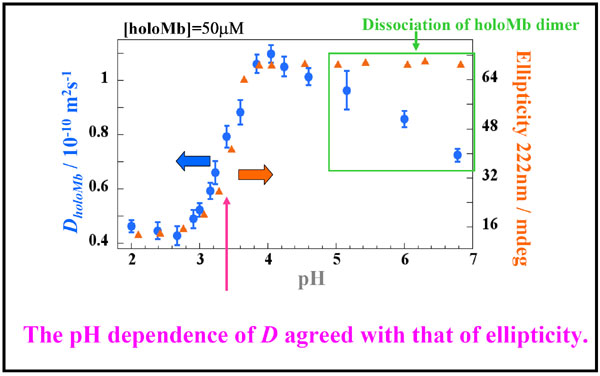
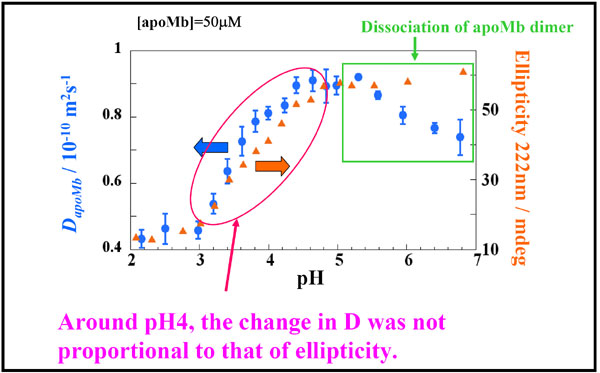
丂丂丂偦偺寢壥丄儂儘儈僆僌儘價儞偱偼丄奼嶶學悢偲CD偺曄壔偼堦抳偟偨偑丄傾億儈僆僌儘價儞偱偼丄pH4晅嬤偱椉幰偵偢傟偑尒傜傟偨丅偡側傢偪丄拞娫懱偱偼folded峔憿偵斾傋偰擇師峔憿偑尭彮偟偰偄傞偵傕偐偐傢傜偢丄奼嶶學悢偼偦傟傎偳戝偒偔曄壔偟側偄丅傓偟傠丄pH4埲壓偺椞堟偱戝偒偔曄壔偟偰偄傞丅偙傟偵偮偄偰丄傑偢夞揮敿宎偺僨乕僞傪梡偄偰峫偊偰傒傞丅抈敀幙偺夞揮敿宎偐傜奼嶶學悢傪梊憐偡傞幃(by He et al. (Biotechnology Progress, 2003))丄
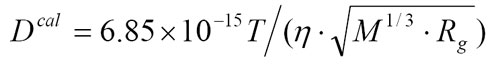
傪梡偄傞偲丄pH7乣4偺奼嶶學悢曄壔偼夞揮敿宎曄壔偩偗偱愢柧偱偒偨偑丄pH4埲崀偺戝偒側奼嶶學悢曄壔偼愢柧偱偒側偐偭偨丅偙偺偙偲偼丄folded忬懺偲堎側傝丄pH2偺unfolded忬懺偱偼儈僆僌儘價儞偲梟攠偲偺憡屳嶌梡偑嫮偔側偭偰偄傞偨傔偲峫偊傜傟傞丅俁師峔憿偑傎偳偗傞偙偲偱丄傾儈僲巁庡嵔偺儁僾僠僪悈慺寢崌偑抈敀撪悈慺寢崌偐傜梟攠暘巕偲偺暘巕娫悈慺寢崌偵曄傢偭偨偨傔偲悇應偝傟傞丅
丂丂丂師偵丄Nishii et al.(Biochemistry, 1994)偑曬崘偟偰偄傞掕埑斾擬偺僨乕僞偲斾妑偟偨丅掕埑斾擬偼丄抈敀幙偺梟攠愙怗昞柺愊偵斾椺偡傞丅
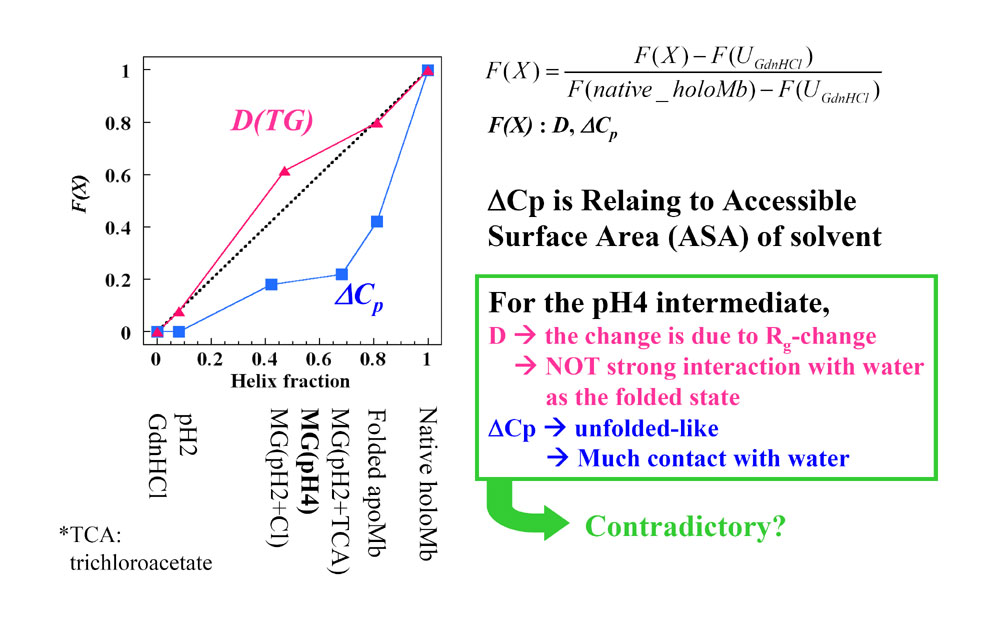
丂丂丂偦偺寢壥丄奼嶶學悢D偲掕埑斾擬嚈Cp偺曄壔偼堦抳偟側偐偭偨丅偲偔偵pH4偱偼奼嶶學悢偼folded偵嬤偄抣傪帵偡堦曽偱丄掕埑斾擬偼unfolded偵嬤偄抣傪帵偟偨丅偳偪傜傕抈敀幙-梟攠憡屳嶌梡傪偁傜傢偡暔棟検偵傕偐偐傢傜偢丄偢傟偑尒傜傟偨偺偼婏柇偱偁傞丅偟偐偟丄偙偺偙偲偼傾億儈僆僌儘價儞pH4拞娫懱慳悈妀撪晹偵悈暘巕偑偄偔偮偐僩儔僢僾偝傟偰偄傞偲峫偊傞偲夝寛偝傟傞丅抈敀幙撪晹偵僩儔僢僾偝傟偨悈暘巕偼抈敀幙偲偲傕偵奼嶶偡傞偨傔丄奼嶶學悢偵偼塭嬁傪梌偊側偄丅
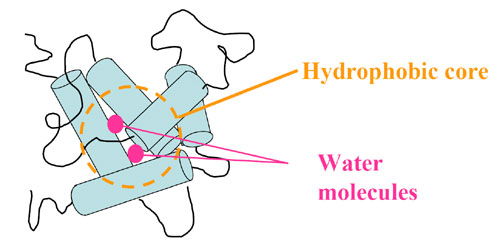
丂偙偺傛偆側悈暘巕傪夘偟偨慳悈寢崌偼丄傾億儈僆僌儘價儞偩偗偱側偔丄Arai et. al.(1996)偵傛傝兛-儔僋僩傾儖僽儈儞偺僼僅乕儖僨傿儞僌拞娫懱偱傕廳梫偱偁傞偲峫偊傜傟偰偄傞丅