TGチーム研究内容一覧へ
光物理化学研究室へ
アポプラストシアニン(アポPc)タンパク質のフォールディング
廣田研究室(奈良先端大)との共同研究です。
タンパク質フォールディング
タンパク質は生体内で合成された直後はアミノ酸が連なっただけの変性状態だが、機能を発現するために、ある特定の天然構造を短時間に自発的に形成する。この過程が、タンパク質フォールディング(折れたたみ)過程である。さまざまな病気がこのフォールディングがうまくすすまなかったために起こると考えられているため、現在、日本だけでなく世界中で活発に研究が行われている。
このフォールディング機構を解明するためには、通常の化学反応機構の解明と同様に、反応速度定数の決定や中間体の特徴づけなど、kinetics(時間分解、実時間測定)の研究が必須である。

フォールディングkineticsの研究のためには、フォールディングの開始法と検出法の選択が重要となる。
フォールディングの開始法と検出法
これまで、開始法としては、高速混合法やレーザー温度ジャンプ法、光誘起還元法などが良く用いられている。また、検出法としては、SAXS(タンパク全体の構造変化を検出)、FRET(タンパクのやや局所的な構造変化を検出)、CD、IR、共鳴ラマン、水素交換NMR・MS(タンパクの二次構造変化を検出)、ANS色素結合法、Trpの蛍光(疎水核形成を検出)が用いられている。
しかし、タンパク質のフォールディング機構を完全に解明するためには、上記情報に加えて、タンパク質全体の構造変化(SAXSよりも高速で検出)およびタンパク質と溶媒との相互作用(疎水相互作用、水素結合)を検出することが必要不可欠である。そのために、本研究では、フォールディングの検出パラメータとして拡散係数を用いることにした。なぜなら、タンパク質拡散係数は、タンパク質表面と溶媒との相互作用を含めたタンパク質全体の大きな構造変化を反映するからである。
さらに、これら構造情報に加えて、フォールディングにともなう熱力学量の情報も得られれば、フォールディング機構をより詳細に議論することが可能になる。なぜなら、これまで平衡条件下ではDSCやファントホッフ解析法により、エンタルピーやエントロピー、熱容量変化が、タンパク質の相互作用の情報と相関付けられてきているからである(例えば、G.I.Makhatatze & P.L.Privalov, Adv. Protein Chem., (1995), A.D.Robertson & K.P.Murphy, Chem. Rev. (1997))。
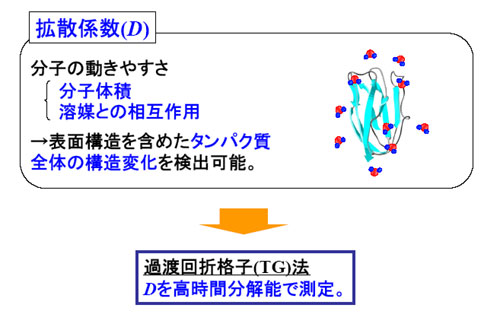
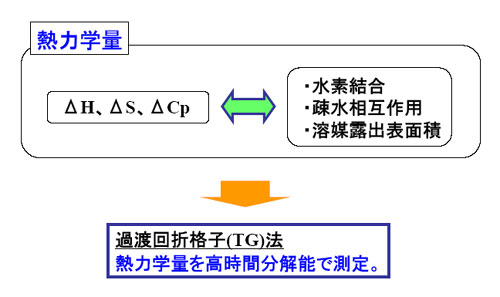
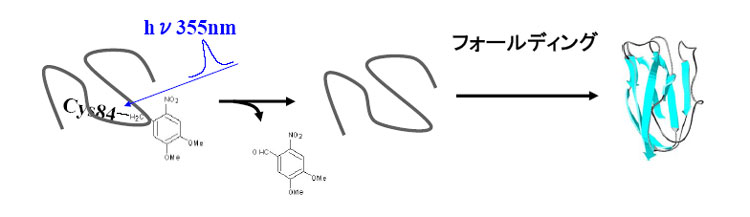
本研究では、拡散係数(D)と熱力学量(エンタルピー変化ΔH、熱容量変化ΔCp、部分体積変化ΔV、熱膨張率変化Δα)を高速で測定するために、検出法として、過渡回折格子(TG)法と過渡レンズ(TrL)法を用いた。また、開始法には、廣田先生(奈良先端大)が開発されたレーザートリガー法を用いた。具体的には、光で解離できるジメトキシニトロベンジル(DMNB)基をアポプラストシアニンというタンパク質につけることで変性させ(修飾アポPc)、DMNB基をレーザーで解離させることでフォールディングを開始させた。
プラストシアニン
プラストシアニンは光合成系において、電子伝達を担う蛋白質である。8本のβストランドからなるGreek-keyβバレル構造を形成しており、電子伝達に重要なCuを有する。Cuをとりのぞいても構造はほとんど変化しない。このCuを除いたプラストシアニンがアポプラストシアニンであり、そのリフォールディングがプロリン異性化をともなうため非常に遅く(分〜時オーダー)NMR観測できるため、β構造蛋白質のフォールディングモデルとして多くの研究が行われてきている(例えば、M.Mizuguchi et al., JMB, 2003, S.Koide et al., Biochemistry, 1993)。しかし、ほとんどのタンパク質の天然構造が一秒以内に形成されることから、アポPcのフォールディングにおいてもその初期過程を調べることが、フォールディング機構解明のために重要となってくる。
 アポPc (PDB:1BYO)
アポPc (PDB:1BYO)
そこで今回は、アポプラストシアニンを光解離性の化学修飾基でラベルすることで変性させ(修飾アポPc)、その修飾基をレーザーで光解離させることで、これまで困難であったβ構造蛋白質のフォールディングにおける初期過程を調べた。
結果
◆結果1(フォールディングスキームと、中間体の拡散係数の決定)
TGでは励起レーザーの交差角を変えることで、さまざまな時間領域のダイナミクスを観測することができる。以下に得られた信号をまとめた(25℃条件下)。これら全時間領域の信号を説明するために以下のような反応スキームを考え、拡散方程式からフィット式を導出し信号をフィットしたところ、非常に良く信号を再現できた。すなわち、楕円で囲った成分が分子拡散信号であり、四角で囲った成分が体積変化キネティックス由来であることが分かった。
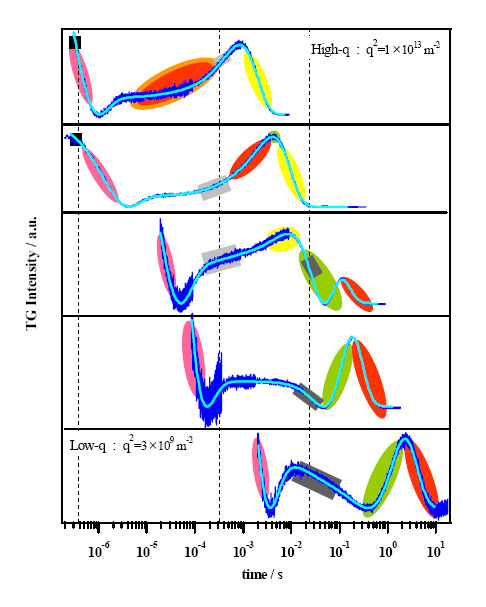
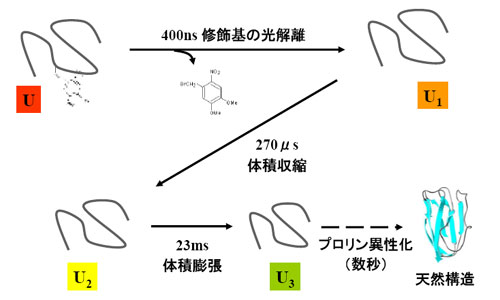
フィット式の導出に用いた反応スキームは以下のとおりであり、フィットの結果、修飾アポPcは、レーザー照射後400nsでDMNB基が解離した後、270μsで体積収縮、23msで拡散係数変化(体積膨張)し、最終的にプロリン異性化を経て天然状態を形成する(CDで確認)ことが分かった(下図)。今回、TGで測定したのはU3までの過程である。以下では、光照射前の状態をU状態、修飾基が解離した直後の状態をU1状態、体積収縮後をU2状態、拡散係数変化後をU3状態と呼ぶ。
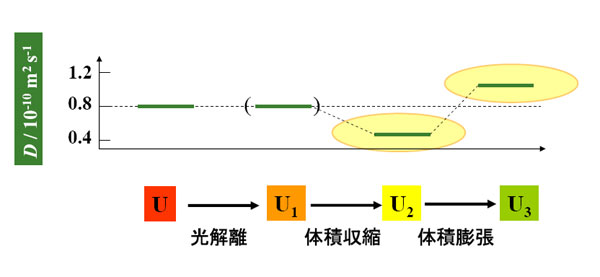
各中間体の拡散係数(D)は、25℃において、D(U)=0.8×10-10m2s-1、D(U2)=0.5×10-10m2s-1、、D(U3)=1.1×10-10m2s-1であった。U1状態は寿命が非常に短いため、TG法でも拡散係数を決定するのは困難であった。
◆結果2(中間体の熱力学量)
TG法では、分子拡散だけでなくもちろん熱拡散も観測される。この熱拡散成分の大きさは、反応にともない放出される熱量に比例する。したがって、修飾アポPcの熱拡散信号の大きさを、吸収した光エネルギーを全て熱として放出するような物質(熱参照物質)の熱拡散TG信号の大きさと比べることで、フォールディングに使われたエネルギーすなわちエンタルピー変化(ΔH)を決定できる。さらにその温度変化から熱容量変化(ΔCp)も決定できる。以下に、得られた各中間体のΔHおよびΔCpを示す。得られた結果は、U2、U3中間体ともに正のΔHおよび負のΔCpであった。
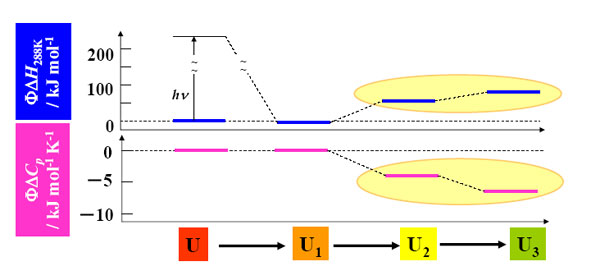
まず、ΔH>0は、ΔS>0を意味する。なぜなら、フォールディングは自発反応であるため、ΔG<0であるからである。この結果は、フォールディングにともなってタンパク質のとり得る構造の数が制限されてくることを考えると予想外である(ΔS<0が予想される)。しかし、これは溶媒の寄与を考えることで解決できる。すなわち、このΔS<0かつΔCpは、これまでの疎水性小分子を用いた研究から、疎水性残基の脱水和過程を示していると結論できた。
また、アポPcではフォールディングにともなう吸収スペクトルの変化がほとんどないため、分子拡散成分の大きさはフォールディングにともなう部分体積変化による屈折率変化に由来する。したがって、アポPcの分子拡散成分の大きさと、熱参照物質の熱拡散成分の大きさの比をとることで、フォールディングにともなう部分体積変化量(ΔV)を決定できる。さらに、その温度変化から熱膨張率(VΔα)も決定できた。
.jpg)
部分体積には、void、水和(親水基、疎水基)、熱による構造揺らぎの寄与があるが、このうち親水基の水和だけが、ΔVとΔαで互いに反対符合になる。すなわち、親水基の水和ではΔV<0、Δα>0であり、逆に親水基の脱水和ではΔV>0、Δα<0になる。このことから、U1→U2では親水基が水和し、U2→U3では親水基が脱水和していることが分かった。この結果は、拡散係数変化の結果とも一致した。
結論
アポPcのフォールディング初期に、疎水凝縮が2段階で起こっていると考えられる。すなわち、一段階目の疎水凝縮で疎水基の脱水和と親水基の水和が起こり、二段階目では疎水基と親水基がともに脱水和する。二段階目は、親水基のreorganaizationを伴った疎水凝縮とみなすことができるかもしれない。




 アポPc (PDB:1BYO)
アポPc (PDB:1BYO)



.jpg)