TGチーム研究内容一覧へ
光物理化学研究室へ
Photoactive Yellow Protein (PYP)の構造変化
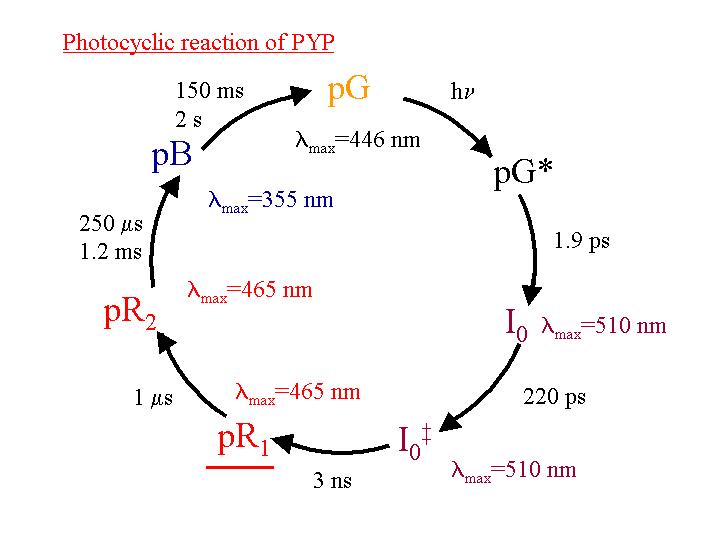
PYPは比較的最近に紅色光合成細菌より単離された水溶性の光受容蛋白質である。発色団はp-クマル酸であり、ロドプシンのレチナールとは異なっているが、光励起後の光サイクルがロドプシンに類似していることから、モデル蛋白質としても多くの興味が寄せられはじめている。このPYPに対し、過渡回折格子(TG)、光音響(PA)法などを適用し、その光サイクルの第一過程におけるエンタルピー変化・体積変化を測定することに成功した。この場合、TG法で観測された時定数は、吸収変化とよく対応しており、発色団付近の構造変化として解釈できる。興味深いことに、その体積変化の値が温度に依存することを見出した。従来の光音響法では、体積変化などは温度変化しないと仮定しなければ解析できず、その妥当性が問題になるが、ここで初めて体積変化にかなり大きい温度依存性があることが示された。数マイクロ秒で減衰する成分は、励起後すぐに放出される熱による成分であり、温度低下と共にdn/dTが小さくなるため強度が減少している。この成分を除いたものが中間体の生成に伴う屈折率変化であるが、温度が低くなるにつれてこの成分も小さくなるのが観測された。吸収スペクトルや反応量子収率の温度依存性を検討した結果、これは温度が低くなるにつれて体積収縮が大きくなっていることに起因していると同定した。PA信号の温度変化からも同様な結果が得られ、常温で−7cm3/molであった体積変化は、0度付近では−15cm3/mol程度にもなっていることがわかった。このような非可逆反応で、体積変化の温度変化が見られたのは、我々の知る限り初めてである。これは中間状態でのPYPの熱膨張係数が大きくなったためであり、構造が「ゆるく」なっているのが原因であると解釈された。
図1 PYPの光サイクル
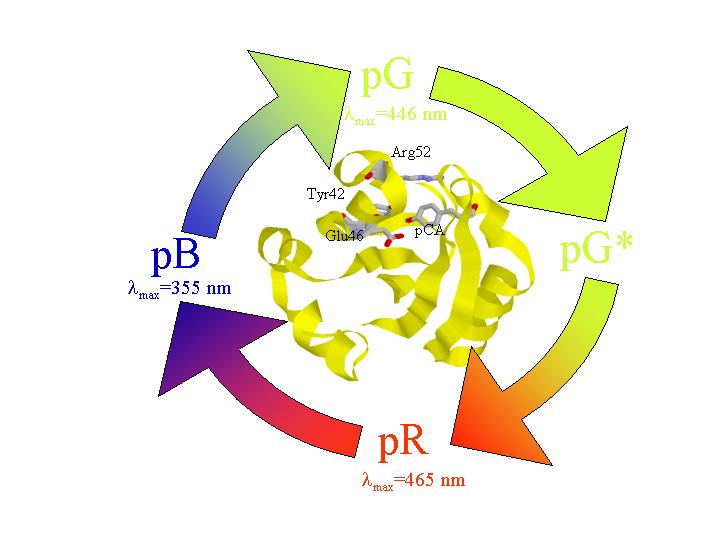
図2 TG法で新しい中間体が観測された。