
高門 輝Akira Takakado

学年 : 博士課程2年
血液型 : A型
連絡先 : takakado at kuchem.kyoto-u.ac.jp
略歴 : 愛媛県(八幡浜高)
趣味 : 読書
コメント: 研究室を盛り上げていけるように頑張ります!
研究内容・業績
研究テーマ
植物体内で青色光センサーとして働くフォトトロピンはN末端側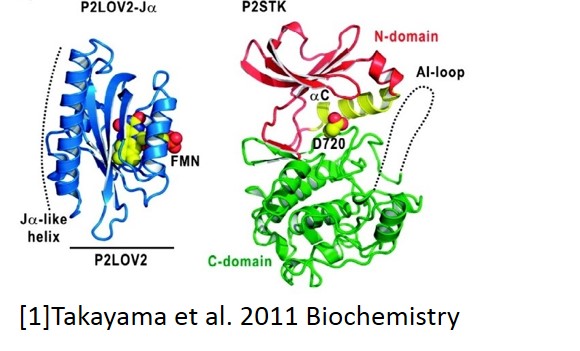 に二つの光センサードメイン(LOV1およびLOV2)を持ち、C末端側にSer/Thrキナーゼドメインを持つ。またLOV2ドメインとキナーゼドメインはリンカードメインによって繋がれており、このリンカーはヘリックスを形成している。暗状態ではLOV2ドメインはキナーゼドメインに結合することでその活性を阻害する働きを持っており、青色光の照射によってLOV2ドメインがキナーゼから解離することがキナーゼの活性化に重要だと考えられている。実際これまで我々はLOV2からリンカーまでを含んだ試料の反応検出を行い、光励起によりリンカーへリックスが解離して、壊れるという二段階の反応過程をとらえている[2]。それぞれの反応速度は140μs、2msであり、これら一連の反応が先述のキナーゼ活性化をもたらすと予想している。我々は実際にキナーゼが活性化される過程をとらえるため、LOV2ドメインからキナーゼドメインまでを含む試料について、過渡回折格子法および過渡レンズ法を用いてその光反応を調べている。
に二つの光センサードメイン(LOV1およびLOV2)を持ち、C末端側にSer/Thrキナーゼドメインを持つ。またLOV2ドメインとキナーゼドメインはリンカードメインによって繋がれており、このリンカーはヘリックスを形成している。暗状態ではLOV2ドメインはキナーゼドメインに結合することでその活性を阻害する働きを持っており、青色光の照射によってLOV2ドメインがキナーゼから解離することがキナーゼの活性化に重要だと考えられている。実際これまで我々はLOV2からリンカーまでを含んだ試料の反応検出を行い、光励起によりリンカーへリックスが解離して、壊れるという二段階の反応過程をとらえている[2]。それぞれの反応速度は140μs、2msであり、これら一連の反応が先述のキナーゼ活性化をもたらすと予想している。我々は実際にキナーゼが活性化される過程をとらえるため、LOV2ドメインからキナーゼドメインまでを含む試料について、過渡回折格子法および過渡レンズ法を用いてその光反応を調べている。
[結果] 過渡レンズ測定の結果、LOV2-キナーゼ試料は光励起により400 μsで体積変化を起こすことが分かった。この体積変化はLOV2-リンカー試料でも観測されており、リンカーの解離過程と同定した。速度のわずかな違いはキナーゼが付いた事による影響と考えている。また過渡回折格子測定では光励起による拡散係数の段階的な変化(2ms,200ms)が観測された。この拡散係数変化はタンパク質の構造変化に由来するものであり、LOV2-キナーゼ試料も光励起により多段階の反応を経て最終生成物に至ることが分かった。我々はこれらの構造変化が光励起によるキナーゼ部位の活性化に重要であると考えている。
[2] Eitoku et al. J. Mol. Biol. 2007. 371:1290-303
業績
学会発表
[1] 光センサー蛋白質フォトトロピンのLOV2-キナーゼ部位における光反応ダイナミクス
第93回日本化学会春季年会 1G8-11 2012年3月 滋賀 (口頭発表)
[2] Light induced signal transduction reaction of LOV2-kinase fragment of phototropin2 from Arabidopsis
33rd International Conference on Solution Chemistry 3PE23 2013年7月 京都 (ポスター発表)
[3] 光反応によるフォトトロピンのLOV2キナーゼ部位における信号伝達ダイナミクス
第 51 回日本生物物理学会年会 3P242 2013年10月 京都 (ポスター発表)


photo-physical-chemistry lab,京都大学大学院理学研究科 化学専攻 光物理化学研究室
〒606-8502
京都府京都市左京区北白川追分町 京都大学大学院理学研究科6号館北棟4階
TEL 075-753-4026
FAX 075-753-4000
<内部連絡用リンク>
Bake Webメール (設 定ページ)
内部連絡