フィトクロムとは
フィトクロム(Phy)は、植物の種子の光発芽、脱黄化、花芽形成、避陰反応など多くの重要な生理機能を制御する赤色/遠赤色光受容タンパク質です。しかし、植物由来のPhyは精製が難しく、物理化学的な手法を用いた測定をすることが困難であり、その信号伝達機構は不明なままです。そんな中、近年の研究によりシアノバクテリアもPhy(シアノバクテリオフィトクロム)を持つことがわかってきました。Cph1はシアノバクテリア由来のPhyであり、その一次構造や吸収スペクトル変化は植物由来のPhyによく似ています(図2.1)。したがって、Cph1の信号伝達機構を明らかにすることで、植物由来のPhyの信号伝達機構を明らかにする重要な手掛かりになると期待されています。
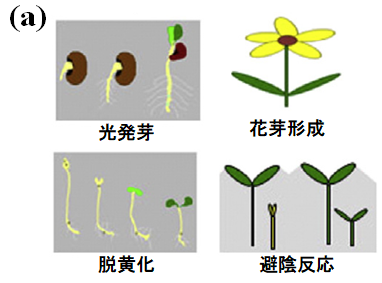
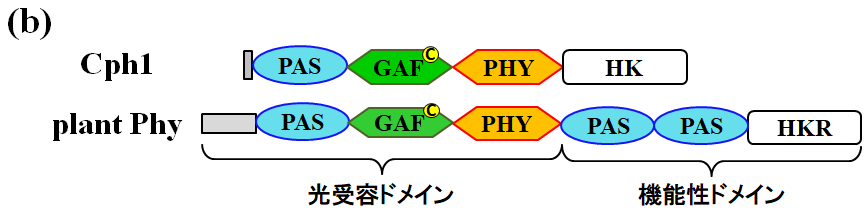
図2.1 (a) 植物由来のPhyが光制御する生理機能の例、(b)Cph1と植物由来のPhyの一次構造
バクテリアフィトクロムCph1
Cph1はN末端側に光受容ドメインを持ち、C末端側にヒスチジンキナーゼドメインを持ちます(図2.1)。Cph1は安定な2つの光状態(Pr, Pfr)をとり、これらは赤色/遠赤色光によって可逆的に切り替わります。この時に、発色団のPCBの幾何異性化が~psで起こることが分かっていますが、その後に起こる蛋白質の高次構造変化のダイナミクスに関してはあまり明らかになっていません。本研究では、赤色光励起によって引き起こされるPr → Pfr反応の光反応ダイナミクスの解明を目指して研究を行ってきました。
■ Cph1の光受容ドメイン(Cph1Δ2)のpH依存光反応ダイナミクスの研究
これまでの研究で、Cph1は複雑な光反応ダイナミクスを取ることがわかっています。そこでまず我々は、Cph1の光反受容ドメインの信号伝達機構を明らかにするために、ヒスチジンキナーゼを切り取った変異体(Cph1Δ2)の光反応ダイナミクス測定に取り組みました。
また近年の先行研究より、Cph1のPr状態には発色団周辺のアミノ酸残基(His260)のプロトン化状態のことなる異性体(Pr-I、Pr-II)が存在し、これらの異性体の存在比率がpHに依存して変化することが報告されています(図2.2)。しかし、これらの異性体でタンパク質全体の構造や光反応ダイナミクスにどのような違いがあるのかは不明なままででした。そこで、本研究ではCph1Δ2のpH依存的光反応ダイナミクスの解明に取り組みました。
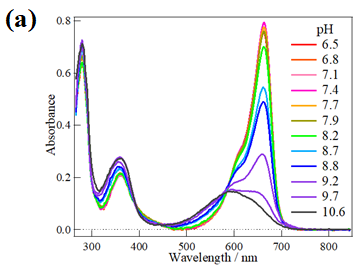
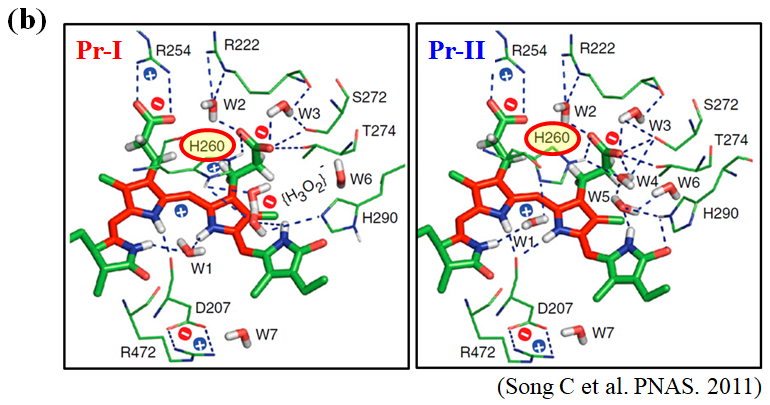
図2.2 (a) 様々なpHで測定したCph1Δ2のPr状態の吸収スペクトル、(b) 先行研究によるPr-IとPr-IIの発色団周りの構造
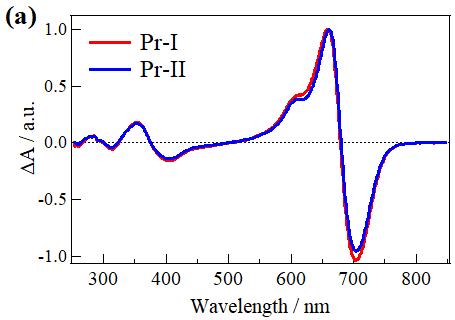
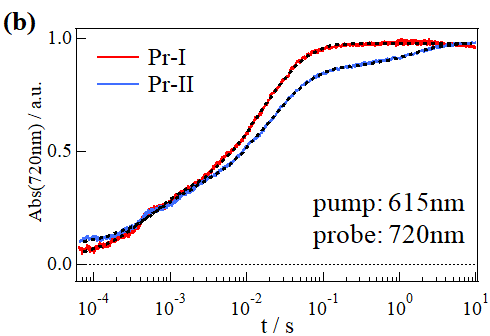
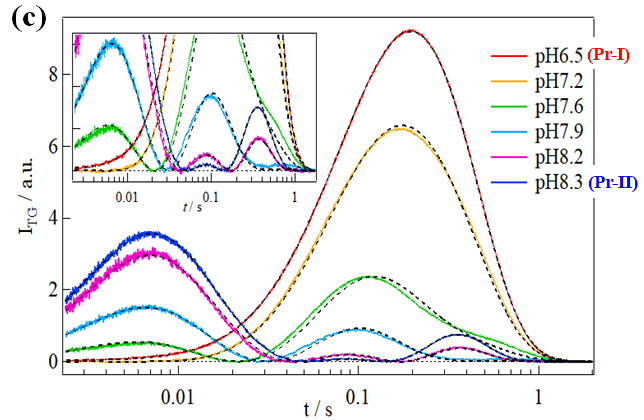
図2.3 (a) Pr-IとPr-IIの吸収差スペクトル(Pr-Pfr)、(b) Pr-IとPr-IIのTrA測定の結果、(c) 様々なpH条件で測定したCph1Δ2のTG信号
吸収変化測定ではあまり違いがないように見えましたが、TG測定の結果Cph1Δ2は2つの異性体で異なる光反応を起こすことがわかりました(図2.3)。これはPr-IとPr-IIタンパク質の高次構造変化のダイナミクスが異なることを意味しています。
Pr-Iの光反応ダイナミクス
本研究ではまず、His260がプロトン化した状態(Pr-I)の光反応ダイナミクスを詳細に調べた。その結果、Pr-Iは吸収変化に同期してD変化を起こしていることが明らかになりました。特に、光励起後1ms以内(~
400μs)にdimerの配向変化を起こすことが明らかになりました(図2.4)。そして、この配向変化は’tongue region’と呼ばれる全てのPhyで共通にアミノ酸配列が保存されている領域の二次構造変化に制御されていることが明らかになりました。
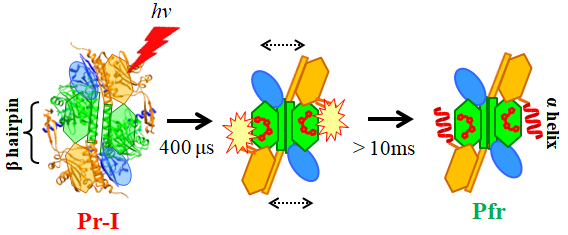
図2.4 Pr-Iの光反応スキーム (Biochemistry. 2018)
Pr-IIの光反応ダイナミクス
Pr-IIの光反応ダイナミクスについては現在解析途中です。
■ 全長Cph1の光反応ダイナミクスの研究
Cph1の信号伝達機構を明らかにするために、全長Cph1の光反応ダイナミクス測定に取り組んでいます。これまでのところ、全長Cph1ではCph1Δ2とは異なり、遅い時定数(
~1s)でDの減少を起こすことが明らかになっています。これは正にヒスチジンキナーゼドメインの構造変化のダイナミクスを表しており、詳細については現在解析中です。